中國首款糖尿病ED干細胞新藥獲批,深圳再生引領細胞治療革命
近日,國家藥品監督管理局藥品審評中心(CDE)宣布,深圳再生細胞集團旗下北京再生細胞研究院申報的“人臍帶間充質干細胞注射液”(受理號:CXSL2500494),正式獲得臨床試驗默示許可。這是我國首款進入臨床階段的治療糖尿病引起的男性勃起功能障礙(ED)干細胞新藥,標志著我國在再生醫學治療細分領域實現新的突破。
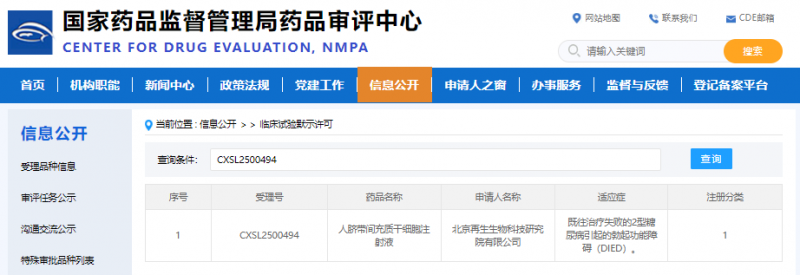
▲截圖來自 CDE 官網
破局臨床痛點,深圳再生搶占千億藍海市場
作為糖尿病最棘手的并發癥之一,糖尿病ED因長期高血糖損傷陰莖海綿體神經與血管,導致傳統PDE5i類藥物對患者療效不佳或無效,臨床治療長期陷入“無藥可用”的困境。而北京細胞研究院研發的BJZS001,在靶向修復緩解血管神經損傷、從根源改善功能和高安全性三個方面具有核心優勢,為患者帶來治療新希望。

▲北京再生細胞研究院
目前,我國糖尿病患者達2.33億,男性患者中63.6%受ED困擾。據第三方測算顯示,2028年國內糖尿病ED治療市場規模將突破600億元,整體市場空間可達千億級。此次BJZS001獲得臨床試驗默示許可,也有望打開這樣一個被長期壓抑的巨大市場。
研發硬實力,深圳再生筑牢行業競爭壁壘
深圳再生細胞集團能夠率先搶占藍海市場的核心入口,得益于其精心構建的從細胞資源庫到臨床轉化的全產業鏈生態,和其在洞察市場需求、解決臨床難題方面的卓越能力。
在細胞制備這一關鍵環節,集團憑借前瞻性的戰略眼光,在北京、東莞、海南布局了三大GMP標準實驗室。針對臨床級人臍帶間充質干細胞(hUCMSCs)生產的核心痛點,北京再生自主研發的“hUCMSCs主細胞庫的制備方法”(專利號:201710374833.8),該技術通過半固體法培養臍帶組織塊,在顯著提高原代培養MSCs得率的同時,有效保留細胞的增殖潛能與分化潛能,更提升了細胞群體均一性。


▲GMP標準實驗室
此外,北京再生在臨床級hUCMSCs生產全流程中執行嚴苛質控,生產環境達到B+A級標準,對原輔材料進行嚴格篩選與管控,建立規范化生產流程與完善的質量管理體系,確保產品可從終端追溯至原始原材料。經專業藥理學試驗研究與臨床前安全性評價驗證,該臨床級hUCMSCs完全滿足治療糖尿病勃起功能障礙(DIED)的臨床質量要求(相關專利:CN202311377729.6),為后續臨床轉化與廣泛應用筑牢技術根基。
此外,在糖尿病健康管理領域的戰略布局中,深圳再生集團不僅憑借技術創新構筑核心優勢,更依托區域政策紅利,在海南博鰲樂城建立海納(海南)糖尿病醫院,為后續技術轉化與服務落地搭建起重要載體。同時,圍繞新藥推進節奏,深圳再生集團正式申請海南博鰲樂城先行區生物醫學新技術項目。借助該區域獨有的“先行先試”政策優勢,包括創新藥更早準入、特殊定價機制等,縮短新藥商業化周期,推動新藥以更快速度進入臨床應用場景。


▲海納(海南)糖尿病醫院
全產業布局,助力我國細胞治療邁向國際前沿
依托“上游細胞藥物研發 — 中游生物技術臨床轉化 — 下游臨床應用”的全產業鏈布局,深圳再生集團正逐步形成“一藥領先、多藥跟進”的強大管線矩陣,有效帶動產業鏈上下游協同與生態構建,推動產業邁向標準化、規模化發展。
作為國內首款針對“2型糖尿病引起的勃起功能障礙(DIED)”的干細胞1類新藥,BJZS001此次獲臨床試驗默示許可,在填補了國內外同適應癥干細胞藥物的市場空白的同時,也標志著我國在干細胞治療男科疾病領域實現了里程碑式的突破性進展,為該領域的技術發展劃定了新高度。
未來,深圳再生細胞集團將繼續加大研發投入,攜手投資者、醫療機構等多方合作伙伴探索干細胞在更多慢性病治療中的應用,為全球生物醫療創新貢獻中國力量。
















